红斑狼疮(lupus erythematosus,LE)可被看作为病谱性疾病,谱的一端为皮肤型红斑狼疮(cutaneous lupus erythematosus,CLE),病变限于皮肤,即使有其他脏器的损害也相对较轻微;谱的另一端为系统性红斑狼疮(systemic lupus erythematosus,SLE),病变累及多系统、多脏器。CLE与SLE之间缺乏明显界限,如多数CLE本身就是SLE的一部分或CLE可转化为SLE或CLE仅是SLE的一个发展阶段。明确为CLE的有慢性皮肤型红斑狼疮(chronic cutaneous lupus erythematosus,CCLE),包括“经典”...[详细]
LE的病因尚未明了,与多因素有关。
发病机制同样尚未明了,在SLE中主要是Ⅲ型变态反应,CLE中主要是Ⅳ型变态反应。但无论SLE还是CLE,其他类型的变态反应也都有参与。下面将简单介绍。 1.CLE LE特异性皮肤损害的发病机制还不清楚。皮肤表现与全身损害之间的关系相当复杂,例如在活动性SLE和稳定性SLE的LE性皮损中没有根本差异,亦即无法在临床、组织病理及直接免疫荧光检查中观察CLE皮损是否伴有全身疾病和判断SLE是否活动。 (1)免疫细胞:LE特异性皮肤损害是一种苔藓样反应,与移植物抗宿主病(GVHD)有相同的机制,是T细胞介导的自身免疫应答所致的损伤。当T细胞功能低下或丧失时就不会有LE的皮损,这可...[详细]
1.CLE (1)CLE的分类:根据Gilliam的分类,CLE可分为“红斑狼疮特异性”与“非红斑狼疮特异性”两大类。 ①红斑狼疮特异性: A.急性皮肤型红斑狼疮(ACLE):局限性,广泛性。 B.亚急性皮肤型红斑狼疮(SCLE):环状红斑型,丘疹鳞屑型。 C.慢性皮肤型红斑狼疮(CCLE):“经典型”DLE——局限性,广泛性肥大性(疣状)ALE。 狼疮性脂膜炎(深在性狼疮);黏膜狼疮;肿胀性(瘤样)狼疮;冻疮样狼疮;DLE——扁平苔藓重叠。 ②非红斑狼疮特异性: A.皮肤血管炎性疾病:血管炎,白细胞破碎性——可触...[详细]
1.急性狼疮肺炎,并发肺出血或发展成成人呼吸窘迫综合征(ARDS)。 2.狼疮性腹膜炎和狼疮性肠系膜血管炎,可出现肠穿孔或肠麻痹、出血性回肠炎和肠套叠,重时还可有肠段坏死。
1.CLE的实验检查 (1)与诊断ACLE和DLE有关的免疫学检查:由于ACLE都伴随于SLE,是SLE的最常见损害。部分DLE也是SLE的症状之一,所以抗体谱都与SLE相同(参见“与诊断SLE有关的免疫学检查”)。 (2)与诊断SCLE有关的免疫学检查:抗Ro和抗La抗体可分别在60%和40%的SCLE患者中出现,尤其是60kD的抗La抗体对诊断最有意义。免疫荧光抗核抗体也可阳性。 2.SLE的实验检查 (1)与诊断SLE有关的免疫学检查: ①LE细胞:虽然活动性SLE血中可出现LE细胞,但由于在检测时受多种因素的影响,实际检出率并不高。但在...[详细]
组织病理:3种LE特异性皮损在组织病理学上的诊断价值DLE>SCLE>ACLE。 DLE、SCLE和ACLE共同的病理学改变是:不同程度的过度角化,基底细胞液化、变性,真皮水肿,真皮-表皮交界处的单核细胞浸润可延伸至真皮。但在SCLE中,基底细胞变性可以是灶性的,而液化更显著,真皮浅层单核细胞浸润可使真-表皮交界不清楚,少数还能见到表皮坏死。细胞浸润通常局限于血管周围和真皮上1/3的附件结构,表皮可有轻度萎缩。有时真-表皮交界处的液化变性会产生囊泡样改变,这在环形SCLE活动性皮损的边界处特别明显,有学者认为这类患者有HLA-DR3表型和抗Ro抗体。DLE的过度角化更严重,附属器的单...[详细]
1.CLE的诊断 诊断CLE根据临床表现、组织病理;ACLE、SCLE和部分DLE还可根据自身抗体的检测。 2.诊断标准 SLE的诊断是排除性诊断,迄今尚无诊断标准。诊断SLE可参考美国风湿病学会(ARA)1997年修订的SLE分类标准,对符合其中4项或4项以上而又除外其他疾病者可诊为SLE(表2)。 3.SLE活动性评价 用“积分法”评价SLE是否活动,根据“积分”来判断疗效,尤其是与继发感染鉴别,有一定实用性。评价SLE活动程度的“积分法”很多,其中的“Out积分法”较为简便,易于应用(表3)。 4.中医病机和辨证 (1)盘状红斑狼疮:...[详细]
LE的治疗原则:个体化。迄今为止,LE的治疗尚无固定的模式,治疗方案的选定要因人、因何脏器损害、因病变程度而定。尤其是对SLE应以尽可能少的糖皮质激素(以下简称激素)等免疫抑制剂达到控制病情的目的。 1.CLE 原则上CLE不系统应用激素,系统治疗以抗疟药为首选。 (1)CCLE:局限性DLE可外用激素霜剂或软膏,封包疗法效果更好;氯喹(Chloroquine,CQ)0.25g/d或羟氯喹(HCQ)0.2~0.4g/d口服,为减少氯喹/羟氯喹(CQ/HCQ)在视网膜的积聚可每周服5天,停2天;如疗效不佳,还可采用局部激素注射。播散性DLE除外用药物外需口服氯喹(CQ)或羟...[详细]
肝脏病变,肝功能在LE的其他脏器的损害均得到控制后仍无好转,预后差。狼疮性肾炎的预后与组织病理分型有关,其中的Ⅳ型弥漫增殖性狼疮性肾炎的预后最差。



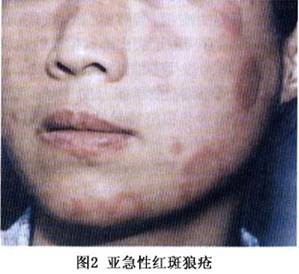
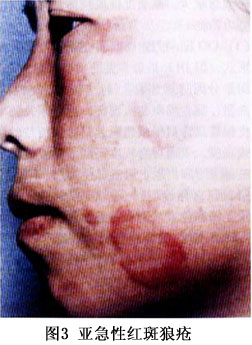 SCLE的皮损最初表现为丘疹或红斑,可发展为带鳞屑的丘疹或环形(多环形)的斑块。约一半的患者呈丘疹鳞屑样或近似于银屑病样的皮损,另一半的患者呈环形(多环形)表现;有的可同时有这两种表现。好发于阳光暴露部位如上背、肩、手臂伸侧、颈胸V字形区,但很少发生于面部。尤其是面部的中心地带。SCLE皮损的少见类型为多形红斑型,如Romell综合征,多发生在血清中有抗La抗体的情况下;更少见的皮损类型为酷似中毒性表皮坏死松解,由强烈的基底细胞损伤产生;剥脱性皮炎罕见。典型的SCLE皮损愈合后不留瘢痕,但可有长期的甚至是永久性的皮肤色素减退或消失,毛细血管扩张也会发生。 少数SCLE除可有ACLE的皮损外,约20%的SCLE可有DLE的皮损,可以在SCLE之前出现。SCLE的DLE通常局限于头皮部,但有时也可以是广泛散在的,并可发生萎缩性瘢痕。秃发、无痛性黏膜损害、甲周毛细血管扩张、皮肤血管炎、雷诺现象和网状青斑等非狼疮特异性皮损也可在SCLE中出现。 根据美国风湿病学会1982年修订的“SLE分类标准”,50%的SCLE可归于SLE。约有20%的SCLE合并有干燥综合征,这些患者除有抗Ro和抗La抗体外其皮损都以环状红斑型为特征,血管炎的发病率亦有升高,组织病理表现为明显的黏蛋白沉积。近10%的SCLE可出现明显的肾脏累及,伴有白细胞减少、高滴度抗核抗体,其皮损以丘疹鳞屑型为特征。 ③CCLE:根据Gilliam的分类,CCLE共有6种形式,但DLE是最常见的类型。DLE分为“局限性”与“播散(全身)性”两种类型,前者局限于头面部,后者累及颈以下部位。皮损特点为扁平或稍隆起、边界清楚的红斑和斑块或丘疹,表面可有程度不同的黏着性鳞屑,祛除这些鳞屑有时能见到形状上类似于地毯钉的“地毯钉征”(角栓刺);随着皮损的缓慢发展,中央呈现萎缩和色素减退、毛细血管扩张,周围色素沉着。DLE好发于暴露于日光的部位如面、手、耳、足、颈部V形区和上肢外侧,头皮也常累及。面部所有区域均可累及,包括眉和眼睑,最好发的部位是颧、鼻、口唇,但鼻唇沟处一般不累及(图4,5)。也可发生于完全不暴露于阳光的区域,如腹股沟处,同形反应可以解释其原因,因DLE皮损可以由外伤引起,如感染、冻伤、灼伤等。不同于ACLE和SCLE,DLE皮损更持久,并可产生瘢痕,尤其是发生于头皮、眉毛处的DLE,因毛囊破坏导致不可逆的瘢痕性秃发。若有明显的角化过度就可形成隆起的肥厚(疣状)皮损,好发于面、上肢伸侧和上背,又称“疣状DLE”或“增生性DLE”、“肥厚性DLE”,此型DLE易有扁平苔藓的表现。DLE若与扁平苔藓并存时即为“DLE——扁平苔藓重叠”。DLE患者多无自觉症状,少数可有轻度瘙痒,但发生于掌跖的DLE疼痛可以相当明显。 CCLE的另一种常见形式为黏膜狼疮,是黏膜的DLE,占CCLE中的25%,口腔黏膜是最好发的部位,尤其是颊黏膜,义齿会促进损害;但鼻腔、生殖器黏膜和眼结膜也可累及。眼结膜累及时损害的瘢痕可能会导致永久性的睫毛脱失和睑外翻。损害开始时可以是疼痛性红斑,以后发展为类似于苔藓样的斑片;颊黏膜的DLE往往呈慢性的、辐射状白色条纹,可有毛细血管扩张;腭黏膜为隆起的白色的过度角化的网状条纹,包绕或间杂着蜂窝状的点状红斑。黏膜DLE的陈旧皮损中心可有疼痛性溃疡和萎缩。黏膜损害可以是活动性SLE的一个特征,但也可发生于没有全身表现的LE患者,与CLE和血清学之间也无明显关联。但有慢性口腔黏膜以及皮肤DLE发展为鳞癌的报道,因此对有不对称的、表现为硬结节的黏膜或皮肤DLE都应该活检以排除鳞癌。
SCLE的皮损最初表现为丘疹或红斑,可发展为带鳞屑的丘疹或环形(多环形)的斑块。约一半的患者呈丘疹鳞屑样或近似于银屑病样的皮损,另一半的患者呈环形(多环形)表现;有的可同时有这两种表现。好发于阳光暴露部位如上背、肩、手臂伸侧、颈胸V字形区,但很少发生于面部。尤其是面部的中心地带。SCLE皮损的少见类型为多形红斑型,如Romell综合征,多发生在血清中有抗La抗体的情况下;更少见的皮损类型为酷似中毒性表皮坏死松解,由强烈的基底细胞损伤产生;剥脱性皮炎罕见。典型的SCLE皮损愈合后不留瘢痕,但可有长期的甚至是永久性的皮肤色素减退或消失,毛细血管扩张也会发生。 少数SCLE除可有ACLE的皮损外,约20%的SCLE可有DLE的皮损,可以在SCLE之前出现。SCLE的DLE通常局限于头皮部,但有时也可以是广泛散在的,并可发生萎缩性瘢痕。秃发、无痛性黏膜损害、甲周毛细血管扩张、皮肤血管炎、雷诺现象和网状青斑等非狼疮特异性皮损也可在SCLE中出现。 根据美国风湿病学会1982年修订的“SLE分类标准”,50%的SCLE可归于SLE。约有20%的SCLE合并有干燥综合征,这些患者除有抗Ro和抗La抗体外其皮损都以环状红斑型为特征,血管炎的发病率亦有升高,组织病理表现为明显的黏蛋白沉积。近10%的SCLE可出现明显的肾脏累及,伴有白细胞减少、高滴度抗核抗体,其皮损以丘疹鳞屑型为特征。 ③CCLE:根据Gilliam的分类,CCLE共有6种形式,但DLE是最常见的类型。DLE分为“局限性”与“播散(全身)性”两种类型,前者局限于头面部,后者累及颈以下部位。皮损特点为扁平或稍隆起、边界清楚的红斑和斑块或丘疹,表面可有程度不同的黏着性鳞屑,祛除这些鳞屑有时能见到形状上类似于地毯钉的“地毯钉征”(角栓刺);随着皮损的缓慢发展,中央呈现萎缩和色素减退、毛细血管扩张,周围色素沉着。DLE好发于暴露于日光的部位如面、手、耳、足、颈部V形区和上肢外侧,头皮也常累及。面部所有区域均可累及,包括眉和眼睑,最好发的部位是颧、鼻、口唇,但鼻唇沟处一般不累及(图4,5)。也可发生于完全不暴露于阳光的区域,如腹股沟处,同形反应可以解释其原因,因DLE皮损可以由外伤引起,如感染、冻伤、灼伤等。不同于ACLE和SCLE,DLE皮损更持久,并可产生瘢痕,尤其是发生于头皮、眉毛处的DLE,因毛囊破坏导致不可逆的瘢痕性秃发。若有明显的角化过度就可形成隆起的肥厚(疣状)皮损,好发于面、上肢伸侧和上背,又称“疣状DLE”或“增生性DLE”、“肥厚性DLE”,此型DLE易有扁平苔藓的表现。DLE若与扁平苔藓并存时即为“DLE——扁平苔藓重叠”。DLE患者多无自觉症状,少数可有轻度瘙痒,但发生于掌跖的DLE疼痛可以相当明显。 CCLE的另一种常见形式为黏膜狼疮,是黏膜的DLE,占CCLE中的25%,口腔黏膜是最好发的部位,尤其是颊黏膜,义齿会促进损害;但鼻腔、生殖器黏膜和眼结膜也可累及。眼结膜累及时损害的瘢痕可能会导致永久性的睫毛脱失和睑外翻。损害开始时可以是疼痛性红斑,以后发展为类似于苔藓样的斑片;颊黏膜的DLE往往呈慢性的、辐射状白色条纹,可有毛细血管扩张;腭黏膜为隆起的白色的过度角化的网状条纹,包绕或间杂着蜂窝状的点状红斑。黏膜DLE的陈旧皮损中心可有疼痛性溃疡和萎缩。黏膜损害可以是活动性SLE的一个特征,但也可发生于没有全身表现的LE患者,与CLE和血清学之间也无明显关联。但有慢性口腔黏膜以及皮肤DLE发展为鳞癌的报道,因此对有不对称的、表现为硬结节的黏膜或皮肤DLE都应该活检以排除鳞癌。
 冻疮样狼疮以指(趾)、足、小腿后侧、肘、膝、鼻和耳等处的红紫色斑片为特征,被湿冷的气候诱发。随着这些损害的发展,DLE的典型的临床和组织病理特征逐步显现。有冻疮样狼疮的患者常在头面部有典型的DLE损害。 深在性狼疮即狼疮性脂膜炎(LEP),也称Kaposi-Irgang病,是CCLE的一种较少见形式。是发生于真皮浅层和皮下组织的炎性损害,绝大部分发生于妇女,约2%的SLE并发此症,也可以单独发生。LEP的临床特征是深部结节,直径在1~3cm,覆盖其上的皮肤可有或无DLE损害;覆盖其上的皮肤会和坚固的皮下结节粘连,并被内拉,形成较深的碟形凹陷。多出现于臀部、胸腹部、上臂和头面部。发生于面部的融合性病变会产生类似脂肪萎缩的外观,在深度陈旧的病灶上可以出现营养不良性钙化,发生在乳房的LEP在临床上和放射学上都类似于肿瘤。 肿胀性LE是CCLE的一种少见形式,皮肤肿胀、发热,类似荨麻疹样斑片,直径数厘米甚至整个面颊或肢体。这种皮肤表现是由于在真皮处有大量黏蛋白沉积所致,而DLE的组织学改变在肿胀性LE不明显,易导致诊断上的混淆。有报道肿胀性LE的光敏率极高。 (3)LE的大疱性皮损:大疱性皮肤损害也可以出现于LE,是LE非特异性皮损之一。它可发生于LE特异性皮损如ACLE和SCLE中,是表皮基底层空泡样变性的直接扩展。基底细胞层的液化变性使表皮下形成裂隙,引起皮肤水疱,偶尔严重时还会产生中毒性表皮坏死松解的表现。大疱性皮损在抗Ro抗体阳性的患者中最易发生,在暴露于紫外线后可产生此类型的皮损;在SCLE患者中,水疱的形成被限制在进展期环状红斑损害的边缘上。DLE很少有表皮下大疱形成。 在SLE中最多出现的是大疱性类天疱疮的皮损(大疱性SLE,BSLE),皮肤直接免疫荧光在表皮-真皮连接处有颗粒或细线状IgG、IgA、IgM及C3的沉积,这种Ig的沉积在电镜下位于基底膜真皮侧的致密板下;间接免疫荧光可在患者血清中检测到抗基底膜抗体,该抗体的分子量为250kD。 其他类型的非狼疮特异性皮肤损害大都伴随于SLE。 (4)CLE与SLE的关系:典型DLE发展为SLE的风险据估计在5%~10%之间。全身性DLE(颈部以上及以下均累及)者有免疫异常的比例更高,比局限性DLE有更高的发展为SLE的可能。也有SLE患者在系统性症状消失后出现DLE皮损。若DLE病人出现弥漫性非瘢痕性秃发、甲周毛细血管扩张、雷诺现象、皮肤血管炎等非特异性LE皮损和全身性淋巴结病,则大都为SLE。当CLE患者出现难以解释的贫血、显著的白细胞减少、梅毒试验假阳性、持续高滴度ANA或抗DNA抗体、高γ-球蛋白血症、血沉的显著升高(>50mm/h)、非阳光暴露区正常皮肤的真-表皮交界处Ig沉积(狼疮带试验阳性)等都是DLE发展为SLE的血清学风险因子。 据估计约1/4的SLE在病程中会出现DLE损害,此时往往预示相对温和的病程,因为弥漫增殖性肾小球肾炎这些致命的SLE往往无DLE损害。疣状DLE与经典DLE相比发展为SLE的可能性更小;约50%的LEP伴随于SLE,但病情相对温和;冻疮样狼疮比经典的DLE更易伴发SLE。浅表的一过性无痛性口腔或鼻腔黏膜溃疡常在活动性SLE病人中出现,并被列入修订的11条SLE分类标准之一;而慢性黏膜DLE最常见于非致命的SLE中,狼疮性肾炎患者很少见到有慢性黏膜DLE。 2.SLE SLE的表现多样,除累及皮肤黏膜、毛发及指甲外,骨关节、肌肉、肾、心血管、肺、肝、脑与神经系统、血液、脾与淋巴结等所有脏器。 (1)全身症状:乏力、体重下降;发热,且多为高热,年轻患者更易发热;均出现于疾病初期。 (2)皮肤黏膜:约80%的患者有皮肤、黏膜损害,可为首发症状(图6)。除前述的不同类型的CLE外皮下类风湿结节也可在SLE中出现。
冻疮样狼疮以指(趾)、足、小腿后侧、肘、膝、鼻和耳等处的红紫色斑片为特征,被湿冷的气候诱发。随着这些损害的发展,DLE的典型的临床和组织病理特征逐步显现。有冻疮样狼疮的患者常在头面部有典型的DLE损害。 深在性狼疮即狼疮性脂膜炎(LEP),也称Kaposi-Irgang病,是CCLE的一种较少见形式。是发生于真皮浅层和皮下组织的炎性损害,绝大部分发生于妇女,约2%的SLE并发此症,也可以单独发生。LEP的临床特征是深部结节,直径在1~3cm,覆盖其上的皮肤可有或无DLE损害;覆盖其上的皮肤会和坚固的皮下结节粘连,并被内拉,形成较深的碟形凹陷。多出现于臀部、胸腹部、上臂和头面部。发生于面部的融合性病变会产生类似脂肪萎缩的外观,在深度陈旧的病灶上可以出现营养不良性钙化,发生在乳房的LEP在临床上和放射学上都类似于肿瘤。 肿胀性LE是CCLE的一种少见形式,皮肤肿胀、发热,类似荨麻疹样斑片,直径数厘米甚至整个面颊或肢体。这种皮肤表现是由于在真皮处有大量黏蛋白沉积所致,而DLE的组织学改变在肿胀性LE不明显,易导致诊断上的混淆。有报道肿胀性LE的光敏率极高。 (3)LE的大疱性皮损:大疱性皮肤损害也可以出现于LE,是LE非特异性皮损之一。它可发生于LE特异性皮损如ACLE和SCLE中,是表皮基底层空泡样变性的直接扩展。基底细胞层的液化变性使表皮下形成裂隙,引起皮肤水疱,偶尔严重时还会产生中毒性表皮坏死松解的表现。大疱性皮损在抗Ro抗体阳性的患者中最易发生,在暴露于紫外线后可产生此类型的皮损;在SCLE患者中,水疱的形成被限制在进展期环状红斑损害的边缘上。DLE很少有表皮下大疱形成。 在SLE中最多出现的是大疱性类天疱疮的皮损(大疱性SLE,BSLE),皮肤直接免疫荧光在表皮-真皮连接处有颗粒或细线状IgG、IgA、IgM及C3的沉积,这种Ig的沉积在电镜下位于基底膜真皮侧的致密板下;间接免疫荧光可在患者血清中检测到抗基底膜抗体,该抗体的分子量为250kD。 其他类型的非狼疮特异性皮肤损害大都伴随于SLE。 (4)CLE与SLE的关系:典型DLE发展为SLE的风险据估计在5%~10%之间。全身性DLE(颈部以上及以下均累及)者有免疫异常的比例更高,比局限性DLE有更高的发展为SLE的可能。也有SLE患者在系统性症状消失后出现DLE皮损。若DLE病人出现弥漫性非瘢痕性秃发、甲周毛细血管扩张、雷诺现象、皮肤血管炎等非特异性LE皮损和全身性淋巴结病,则大都为SLE。当CLE患者出现难以解释的贫血、显著的白细胞减少、梅毒试验假阳性、持续高滴度ANA或抗DNA抗体、高γ-球蛋白血症、血沉的显著升高(>50mm/h)、非阳光暴露区正常皮肤的真-表皮交界处Ig沉积(狼疮带试验阳性)等都是DLE发展为SLE的血清学风险因子。 据估计约1/4的SLE在病程中会出现DLE损害,此时往往预示相对温和的病程,因为弥漫增殖性肾小球肾炎这些致命的SLE往往无DLE损害。疣状DLE与经典DLE相比发展为SLE的可能性更小;约50%的LEP伴随于SLE,但病情相对温和;冻疮样狼疮比经典的DLE更易伴发SLE。浅表的一过性无痛性口腔或鼻腔黏膜溃疡常在活动性SLE病人中出现,并被列入修订的11条SLE分类标准之一;而慢性黏膜DLE最常见于非致命的SLE中,狼疮性肾炎患者很少见到有慢性黏膜DLE。 2.SLE SLE的表现多样,除累及皮肤黏膜、毛发及指甲外,骨关节、肌肉、肾、心血管、肺、肝、脑与神经系统、血液、脾与淋巴结等所有脏器。 (1)全身症状:乏力、体重下降;发热,且多为高热,年轻患者更易发热;均出现于疾病初期。 (2)皮肤黏膜:约80%的患者有皮肤、黏膜损害,可为首发症状(图6)。除前述的不同类型的CLE外皮下类风湿结节也可在SLE中出现。 (3)骨关节和肌肉:骨关节和肌肉症状常与SLE的病情活动有关。 ①关节:系炎症性关节病,大小关节均可受累,呈游走性关节肿胀、疼痛,多为对称性。晨僵亦多见,但<30min。关节不发生畸形,但Jaccord综合征有指关节畸形,出现关节半脱位和挛缩,易与类风湿关节炎的手畸形混淆。 ②骨:无菌性骨坏死,通常发生于股骨头等负重关节。无菌性骨坏死既可以是SLE的原发病变,也可以继发于使用糖皮质激素后。 ③肌肉:出现肌痛、肌无力和压痛,甚至还可有血清肌酶升高和类似肌炎的组织学改变。肌肉症状也以近端为著。 (4)肾脏:肾脏受累很常见,有临床症状者可达70%,肾活检或尸检肾受累几乎达100%。表现为肾炎或肾病综合征,出现程度不同的蛋白尿、血尿、白细胞尿、管型尿、水肿、高血压及肾功能不全等。狼疮性肾炎的预后与组织病理分型有关,其中的Ⅳ型弥漫增殖性狼疮性肾炎的预后最差(表1)。
(3)骨关节和肌肉:骨关节和肌肉症状常与SLE的病情活动有关。 ①关节:系炎症性关节病,大小关节均可受累,呈游走性关节肿胀、疼痛,多为对称性。晨僵亦多见,但<30min。关节不发生畸形,但Jaccord综合征有指关节畸形,出现关节半脱位和挛缩,易与类风湿关节炎的手畸形混淆。 ②骨:无菌性骨坏死,通常发生于股骨头等负重关节。无菌性骨坏死既可以是SLE的原发病变,也可以继发于使用糖皮质激素后。 ③肌肉:出现肌痛、肌无力和压痛,甚至还可有血清肌酶升高和类似肌炎的组织学改变。肌肉症状也以近端为著。 (4)肾脏:肾脏受累很常见,有临床症状者可达70%,肾活检或尸检肾受累几乎达100%。表现为肾炎或肾病综合征,出现程度不同的蛋白尿、血尿、白细胞尿、管型尿、水肿、高血压及肾功能不全等。狼疮性肾炎的预后与组织病理分型有关,其中的Ⅳ型弥漫增殖性狼疮性肾炎的预后最差(表1)。 WHO狼疮性肾炎病理分型: Ⅰ型——正常肾组织 Ⅱ型——系膜增殖性狼疮性肾炎 Ⅲ型——局灶增殖性狼疮性肾炎 Ⅳ型——弥漫增殖性狼疮性肾炎 Ⅴ型——膜性狼疮性肾炎 Ⅵ型——硬化性狼疮性肾炎(Ⅳ型、Ⅴ型的表现) 狼疮性间质性肾炎(肾小管间质炎症,肾小球损害轻) (5)血液系统: ①贫血:贫血的轻重与病情严重程度和病程长短有关,多为轻至中度。可分为二大类,一类为非免疫性贫血,较多见,缺铁性和再生障碍性贫血也包括其中。另一类为自身免疫性溶血性贫血,多由抗红细胞抗体、冷凝集蛋白及药物所致,伴有网织红细胞增多,Coomb试验阳性,脾大,血结合珠蛋白水平降低等。虽然自身免疫性溶血性贫血对诊断SLE具有重要意义,但临床上发生率并不高。 ②白细胞异常:主要是中性粒细胞和淋巴细胞数减少,前者<4.5×109/L,后者<1.5×109/L,并可检测到抗这两种细胞的抗体。嗜酸性粒细胞增多,可达白细胞总数的10%。嗜碱性粒细胞减少。 ③血小板减少和功能异常:血小板减少在SLE中非常多见,抗血小板抗体是引起血小板减少的主要原因。血小板功能异常表现为黏附、聚集功能异常。原发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)和血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)与SLE有较强的相关性,可与SLE的其他症状一齐出现或先有ITP或TTP,数年后成SLE。 ④骨髓:常见骨髓增生低下,少见骨髓纤维化。 ⑤脾和淋巴结:脾可肿大,甚至脾功能亢进;少有脾萎缩,伴脾功能低下。淋巴结肿大以颈部和腋窝最多见。 (6)呼吸系统: ①胸膜:多为双侧胸膜炎,可以是首发症状。胸腔积液为渗出性,涂片中可见狼疮细胞,抗核抗体阳性,其滴度与血清中相似或更高,补体降低。 ②肺浸润性病变:分为: A.急性狼疮肺炎:并发肺出血或发展成成人呼吸窘迫综合征(ARDS)。 B.慢性狼疮肺炎:即弥漫性肺间质纤维化(间质性肺炎,ILD),多见于病程长的患者,肺功能检查呈限制性通气障碍,肺容量降低,一氧化碳(CO)弥散功能是最敏感的检测方法。高分辨率CT(HRCT)联合CO弥散功能检测能早期发现ILD患者。 ③肺动脉高压和肺栓塞:二者都和抗心磷脂抗体有关。肺动脉高压还可继发于ILD,而肺栓塞往往由抗心磷脂抗体直接引起。 (7)心血管: ①心包炎:最常见,心包积液为渗出液。超声心动图是最敏感的诊断方法。 ②心肌病变:发生率高,但出现临床症状少。心肌炎时外周血肌酶可升高。超声心动图是诊断心肌病变的较敏感方法,主要征象是左室功能异常。 ③冠状动脉病变:冠状动脉粥样硬化是SLE死亡的重要原因之一,诊断困难在于患者可无心前区疼痛,即使发生心肌梗死时也无疼痛。冠状动脉栓塞与抗心磷脂抗体有关。 (8)消化系统: ①消化道表现:食欲不振、恶心呕吐、腹泻,在SLE中非常多见;吸收不良,食管蠕动障碍,出血性胃炎等也可出现。 ②肝脏病变:最多见的肝脏病变为肝功能异常,重者有低蛋白血症、肝肿大和黄疸。其中“狼疮性肝炎”的病理改变与慢活肝相似,大都出现均质型抗核抗体、抗平滑肌抗体及抗线粒体抗体,肝功能在LE的其他脏器的损害均得到控制后仍无好转,预后差。 ③狼疮性腹膜炎和狼疮性肠系膜血管炎:前者以腹痛为主要表现,并可出现少量腹水,还可引起肠粘连、肠梗阻。后者为持续性腹部绞痛、发热、血便及腹膜炎的症状,以及肠穿孔或肠麻痹、出血性回肠炎和肠套叠,重时还可有肠段坏死。 ④胰腺炎:较少见。LE性胰腺炎多由胰腺血管炎引起,此类患者大都有典型的皮肤血管炎表现以及雷诺现象;临床表现可不典型,血、尿淀粉酶恢复较慢,可在症状完全消失、影像学检查完全恢复后而血、尿淀粉酶仍不恢复。LE性胰腺炎几乎都为轻型(水肿性),可发展为慢性,重型(出血坏死性)罕见。 (9)神经精神系统: ①神经系统:癫痫常见,其次为脑血管病、颅神经麻痹、周围神经病变等。血清中抗淋巴细胞抗体、抗神经元抗体以及α干扰素增高与狼疮性脑病有关。脑脊液中细胞数、蛋白、抗核抗体、IgG和免疫复合物水平升高、C4和葡萄糖水平降低对诊断狼疮性脑病有帮助。脑电图在活动性狼疮性脑病时约80%都显示异常,呈弥散性慢波节律,如有癫痫时则呈局灶性棘波、尖波或慢波。 ②精神障碍:主要表现为: A.精神病样反应,以精神分裂症最多见。 B.器质性脑病综合征。 C.情感障碍和神经反应,多表现为忧郁症,反应淡漠,焦虑,有自杀倾向。 糖皮质激素的治疗也会引起精神症状,但主要表现为欣快、兴奋、失眠以及焦虑等。 磁共振(MRI)检查对早期诊断很有意义。MRI可发现无临床症状和体征的SLE患者有脑缺血或梗死灶,尤其是在抗心磷脂抗体阳性和有皮肤血管炎的患者中;MRI显示弥漫性脑部病变,往往会出现精神症状。 3.药物性红斑狼疮 药物性红斑狼疮是药物诱发的在临床表现与血清学反应上与自发的SLE极为相似的综合征。其临床特点为:症状和实验检查的异常是可逆的,停药后可自行消失;症状较轻,以全身症状、关节炎、浆膜炎为主要表现,也可有肝功能异常、肝脏肿大和皮疹,但肾脏、中枢神经系统和血液系统很少累及;发病年龄大于自发性SLE,以中老年为主;血清学检测除有抗核抗体外,90%以上的药物性红斑狼疮可检测到抗组蛋白抗体。虽然有报道30余种药物可诱发LE,但已确定并在临床上广泛应用的有肼苯达嗪、普鲁卡因胺、异烟肼、氯丙嗪、甲基多巴以及青霉胺、甲巯咪唑(他巴唑)和口服避孕药等。
WHO狼疮性肾炎病理分型: Ⅰ型——正常肾组织 Ⅱ型——系膜增殖性狼疮性肾炎 Ⅲ型——局灶增殖性狼疮性肾炎 Ⅳ型——弥漫增殖性狼疮性肾炎 Ⅴ型——膜性狼疮性肾炎 Ⅵ型——硬化性狼疮性肾炎(Ⅳ型、Ⅴ型的表现) 狼疮性间质性肾炎(肾小管间质炎症,肾小球损害轻) (5)血液系统: ①贫血:贫血的轻重与病情严重程度和病程长短有关,多为轻至中度。可分为二大类,一类为非免疫性贫血,较多见,缺铁性和再生障碍性贫血也包括其中。另一类为自身免疫性溶血性贫血,多由抗红细胞抗体、冷凝集蛋白及药物所致,伴有网织红细胞增多,Coomb试验阳性,脾大,血结合珠蛋白水平降低等。虽然自身免疫性溶血性贫血对诊断SLE具有重要意义,但临床上发生率并不高。 ②白细胞异常:主要是中性粒细胞和淋巴细胞数减少,前者<4.5×109/L,后者<1.5×109/L,并可检测到抗这两种细胞的抗体。嗜酸性粒细胞增多,可达白细胞总数的10%。嗜碱性粒细胞减少。 ③血小板减少和功能异常:血小板减少在SLE中非常多见,抗血小板抗体是引起血小板减少的主要原因。血小板功能异常表现为黏附、聚集功能异常。原发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)和血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)与SLE有较强的相关性,可与SLE的其他症状一齐出现或先有ITP或TTP,数年后成SLE。 ④骨髓:常见骨髓增生低下,少见骨髓纤维化。 ⑤脾和淋巴结:脾可肿大,甚至脾功能亢进;少有脾萎缩,伴脾功能低下。淋巴结肿大以颈部和腋窝最多见。 (6)呼吸系统: ①胸膜:多为双侧胸膜炎,可以是首发症状。胸腔积液为渗出性,涂片中可见狼疮细胞,抗核抗体阳性,其滴度与血清中相似或更高,补体降低。 ②肺浸润性病变:分为: A.急性狼疮肺炎:并发肺出血或发展成成人呼吸窘迫综合征(ARDS)。 B.慢性狼疮肺炎:即弥漫性肺间质纤维化(间质性肺炎,ILD),多见于病程长的患者,肺功能检查呈限制性通气障碍,肺容量降低,一氧化碳(CO)弥散功能是最敏感的检测方法。高分辨率CT(HRCT)联合CO弥散功能检测能早期发现ILD患者。 ③肺动脉高压和肺栓塞:二者都和抗心磷脂抗体有关。肺动脉高压还可继发于ILD,而肺栓塞往往由抗心磷脂抗体直接引起。 (7)心血管: ①心包炎:最常见,心包积液为渗出液。超声心动图是最敏感的诊断方法。 ②心肌病变:发生率高,但出现临床症状少。心肌炎时外周血肌酶可升高。超声心动图是诊断心肌病变的较敏感方法,主要征象是左室功能异常。 ③冠状动脉病变:冠状动脉粥样硬化是SLE死亡的重要原因之一,诊断困难在于患者可无心前区疼痛,即使发生心肌梗死时也无疼痛。冠状动脉栓塞与抗心磷脂抗体有关。 (8)消化系统: ①消化道表现:食欲不振、恶心呕吐、腹泻,在SLE中非常多见;吸收不良,食管蠕动障碍,出血性胃炎等也可出现。 ②肝脏病变:最多见的肝脏病变为肝功能异常,重者有低蛋白血症、肝肿大和黄疸。其中“狼疮性肝炎”的病理改变与慢活肝相似,大都出现均质型抗核抗体、抗平滑肌抗体及抗线粒体抗体,肝功能在LE的其他脏器的损害均得到控制后仍无好转,预后差。 ③狼疮性腹膜炎和狼疮性肠系膜血管炎:前者以腹痛为主要表现,并可出现少量腹水,还可引起肠粘连、肠梗阻。后者为持续性腹部绞痛、发热、血便及腹膜炎的症状,以及肠穿孔或肠麻痹、出血性回肠炎和肠套叠,重时还可有肠段坏死。 ④胰腺炎:较少见。LE性胰腺炎多由胰腺血管炎引起,此类患者大都有典型的皮肤血管炎表现以及雷诺现象;临床表现可不典型,血、尿淀粉酶恢复较慢,可在症状完全消失、影像学检查完全恢复后而血、尿淀粉酶仍不恢复。LE性胰腺炎几乎都为轻型(水肿性),可发展为慢性,重型(出血坏死性)罕见。 (9)神经精神系统: ①神经系统:癫痫常见,其次为脑血管病、颅神经麻痹、周围神经病变等。血清中抗淋巴细胞抗体、抗神经元抗体以及α干扰素增高与狼疮性脑病有关。脑脊液中细胞数、蛋白、抗核抗体、IgG和免疫复合物水平升高、C4和葡萄糖水平降低对诊断狼疮性脑病有帮助。脑电图在活动性狼疮性脑病时约80%都显示异常,呈弥散性慢波节律,如有癫痫时则呈局灶性棘波、尖波或慢波。 ②精神障碍:主要表现为: A.精神病样反应,以精神分裂症最多见。 B.器质性脑病综合征。 C.情感障碍和神经反应,多表现为忧郁症,反应淡漠,焦虑,有自杀倾向。 糖皮质激素的治疗也会引起精神症状,但主要表现为欣快、兴奋、失眠以及焦虑等。 磁共振(MRI)检查对早期诊断很有意义。MRI可发现无临床症状和体征的SLE患者有脑缺血或梗死灶,尤其是在抗心磷脂抗体阳性和有皮肤血管炎的患者中;MRI显示弥漫性脑部病变,往往会出现精神症状。 3.药物性红斑狼疮 药物性红斑狼疮是药物诱发的在临床表现与血清学反应上与自发的SLE极为相似的综合征。其临床特点为:症状和实验检查的异常是可逆的,停药后可自行消失;症状较轻,以全身症状、关节炎、浆膜炎为主要表现,也可有肝功能异常、肝脏肿大和皮疹,但肾脏、中枢神经系统和血液系统很少累及;发病年龄大于自发性SLE,以中老年为主;血清学检测除有抗核抗体外,90%以上的药物性红斑狼疮可检测到抗组蛋白抗体。虽然有报道30余种药物可诱发LE,但已确定并在临床上广泛应用的有肼苯达嗪、普鲁卡因胺、异烟肼、氯丙嗪、甲基多巴以及青霉胺、甲巯咪唑(他巴唑)和口服避孕药等。 3.SLE活动性评价 用“积分法”评价SLE是否活动,根据“积分”来判断疗效,尤其是与继发感染鉴别,有一定实用性。评价SLE活动程度的“积分法”很多,其中的“Out积分法”较为简便,易于应用(表3)。
3.SLE活动性评价 用“积分法”评价SLE是否活动,根据“积分”来判断疗效,尤其是与继发感染鉴别,有一定实用性。评价SLE活动程度的“积分法”很多,其中的“Out积分法”较为简便,易于应用(表3)。 4.中医病机和辨证 (1)盘状红斑狼疮: ①气血淤滞型: 主证:皮损局限面部、手背,或少数患者可呈四肢躯干播散发生,表现为红斑鳞屑、角化性皮损,有毛囊角栓,有萎缩,患者常有倦怠、纳差,舌质暗红,脉沉或沉细。 辨证:经络阻隔,气血淤滞。 ②阴虚火旺型: 主证:多有口唇及口内黏膜损害,表现为角化性白斑或糜烂,有口舌干燥,口干渴,不思饮,舌红苔白或腻,脉象细数。 辨证:肾阴虚损,阴虚火旺。 (2)亚急性皮肤型红斑狼疮: 主证:皮肤损害多在面部或四肢出现环状红斑样损害,患者自觉面部发热,心烦热,有时有关节疼痛,内脏损伤轻微。 辨证:脾肾不足,毒热郁于血分。 (3)系统性红斑狼疮:中医认为本病发生多因先天禀赋不足,后天又失调养,致使阴阳不调,气血失衡,经脉阻隔,气血淤滞;或因七情内伤,气急恼怒、过度疲劳等因素,伤及脏腑;而日光照射,邪热入里,外感毒邪等,又是发病的主要诱因。 急性活动期多属毒热炽盛,可出现气血两燔的征候,如红斑、高热、神昏谵语等;久热耗气伤阴,气阴两伤可出现低热乏力,唇干舌红,言语低微症状。毒热淤滞,阻隔经络,可出现肌肉酸楚;关节疼痛等症状;病久不愈,致使五脏俱虚,出现各种错综复杂的征候:病邪入心,证见惊悸怔恐:病邪入肝,证见两肋胀疼,口苦咽干;病邪入脾,则可见四肢无力,胸脘痞满,腹胀纳差,四肢水肿;邪入心包,则有神昏谵语;肾为先天之本,主一身之阴阳,阴阳互根,阴虚日久,亦可损及阳,而出现阴阳俱虚之证,证见面色苍白,腰膝酸软无力,发枯易脱,耳鸣失聪,尿色清长或为尿闭,四肢不温,全身水肿等。总之,此病在整个病程中可出现虚实夹杂,寒热交错等多种复杂现象,最后可因毒热内攻,五脏俱虚,气血淤滞,阴阳离决而死亡。 中医辨证分型: ①毒热炽盛型: 主证:高热烦躁、面部红斑或出血斑,肌肉酸痛,关节疼痛,精神恍惚,严重时神昏谵语,抽搐,口渴思冷饮。舌质红绛,苔黄,或见镜面舌,脉数。 辨证:热入营血,气血两燔。 ②气阴两伤型: 主证:高热后或持续低热,手足心热,心烦,少气懒言,面色不华,视物模糊,失眠,关节疼痛,脱发。舌质红无苔,脉细数而软。 辨证:气阴两伤,血脉淤滞。 ③脾肾两虚型: 主证:面色苍白,少气懒言,腰膝酸冷,便溏或五更泄泻;或小便不利,面浮肢肿,甚则腹胀如鼓。舌质淡胖或边有齿痕,苔白滑,脉沉细。或头晕目眩,失眠多梦,耳鸣健忘,腰膝酸软,两胁作痛,五心烦热,颧红盗汗,女子月经量少,甚或口舌生疮,时有低热。舌红少苔,脉细数。 辨证:脾肾两虚,气血失和。 ④脾虚肝郁型: 主证:自觉肝区作痛,腹胀纳呆,头昏目眩,失眠多梦,皮肤红斑,瘀斑或舌有紫斑,重者肝脾肿大,呕血便血,女子月经不调或闭经,脉弦。 辨证:脾虚肝郁,气血淤滞。 ⑤风湿痹阻型: 主证:以关节肌肉疼痛为主,有时可有肢体麻木,皮肤红斑结节,或见环状红斑,间有低热,舌质红苔白,脉弦滑。 辨证:风湿痹阻,经脉不通。
4.中医病机和辨证 (1)盘状红斑狼疮: ①气血淤滞型: 主证:皮损局限面部、手背,或少数患者可呈四肢躯干播散发生,表现为红斑鳞屑、角化性皮损,有毛囊角栓,有萎缩,患者常有倦怠、纳差,舌质暗红,脉沉或沉细。 辨证:经络阻隔,气血淤滞。 ②阴虚火旺型: 主证:多有口唇及口内黏膜损害,表现为角化性白斑或糜烂,有口舌干燥,口干渴,不思饮,舌红苔白或腻,脉象细数。 辨证:肾阴虚损,阴虚火旺。 (2)亚急性皮肤型红斑狼疮: 主证:皮肤损害多在面部或四肢出现环状红斑样损害,患者自觉面部发热,心烦热,有时有关节疼痛,内脏损伤轻微。 辨证:脾肾不足,毒热郁于血分。 (3)系统性红斑狼疮:中医认为本病发生多因先天禀赋不足,后天又失调养,致使阴阳不调,气血失衡,经脉阻隔,气血淤滞;或因七情内伤,气急恼怒、过度疲劳等因素,伤及脏腑;而日光照射,邪热入里,外感毒邪等,又是发病的主要诱因。 急性活动期多属毒热炽盛,可出现气血两燔的征候,如红斑、高热、神昏谵语等;久热耗气伤阴,气阴两伤可出现低热乏力,唇干舌红,言语低微症状。毒热淤滞,阻隔经络,可出现肌肉酸楚;关节疼痛等症状;病久不愈,致使五脏俱虚,出现各种错综复杂的征候:病邪入心,证见惊悸怔恐:病邪入肝,证见两肋胀疼,口苦咽干;病邪入脾,则可见四肢无力,胸脘痞满,腹胀纳差,四肢水肿;邪入心包,则有神昏谵语;肾为先天之本,主一身之阴阳,阴阳互根,阴虚日久,亦可损及阳,而出现阴阳俱虚之证,证见面色苍白,腰膝酸软无力,发枯易脱,耳鸣失聪,尿色清长或为尿闭,四肢不温,全身水肿等。总之,此病在整个病程中可出现虚实夹杂,寒热交错等多种复杂现象,最后可因毒热内攻,五脏俱虚,气血淤滞,阴阳离决而死亡。 中医辨证分型: ①毒热炽盛型: 主证:高热烦躁、面部红斑或出血斑,肌肉酸痛,关节疼痛,精神恍惚,严重时神昏谵语,抽搐,口渴思冷饮。舌质红绛,苔黄,或见镜面舌,脉数。 辨证:热入营血,气血两燔。 ②气阴两伤型: 主证:高热后或持续低热,手足心热,心烦,少气懒言,面色不华,视物模糊,失眠,关节疼痛,脱发。舌质红无苔,脉细数而软。 辨证:气阴两伤,血脉淤滞。 ③脾肾两虚型: 主证:面色苍白,少气懒言,腰膝酸冷,便溏或五更泄泻;或小便不利,面浮肢肿,甚则腹胀如鼓。舌质淡胖或边有齿痕,苔白滑,脉沉细。或头晕目眩,失眠多梦,耳鸣健忘,腰膝酸软,两胁作痛,五心烦热,颧红盗汗,女子月经量少,甚或口舌生疮,时有低热。舌红少苔,脉细数。 辨证:脾肾两虚,气血失和。 ④脾虚肝郁型: 主证:自觉肝区作痛,腹胀纳呆,头昏目眩,失眠多梦,皮肤红斑,瘀斑或舌有紫斑,重者肝脾肿大,呕血便血,女子月经不调或闭经,脉弦。 辨证:脾虚肝郁,气血淤滞。 ⑤风湿痹阻型: 主证:以关节肌肉疼痛为主,有时可有肢体麻木,皮肤红斑结节,或见环状红斑,间有低热,舌质红苔白,脉弦滑。 辨证:风湿痹阻,经脉不通。 浙公网安备
33010902000463号
浙公网安备
33010902000463号



